Perubahan entalpi reaksi dapat ditentukan dengan menggunakan suatu alat yang disebut kalorimeter (alat pengukur kalor). Dalam kalorimeter, zat yang akan direaksikan dimasukkan ke dalam tempat reaksi. Tempat ini dikelilingi oleh air yang telah diketahui massanya. Kalor reaksi yang dibebaskan terserap oleh air dan suhu air akan naik. Perubahan suhu air ini diukur dengan termometer. Kalorimeter ditempatkan dalam wadah terisolasi yang berisi air untuk menghindarkan terlepasnya kalor.
Gambar Kalorimeter
Berdasarkan hasil penelitian, untuk menaikkan suhu 1 kg air sebesar 10C diperlukan kalor sebesar 4,2 kJ atau 1 kkal. Untuk 1 gram air diperlukan kalor sebesar 4,2 J atau 1 kal. Jumlah kalor ini disebut kalor jenis air dengan lambang c. Jumlah kalor yang terserap ke dalam air dihitung dengan mengalikan 3 faktor yaitu massa air dalam kalorimeter (gram), perubahan suhu air (0C), dan kalor jenis air. Rumusnya ditulis:
Jumlah kalor yang terserap ke dalam air dihitung dengan mengalikan 3 faktor yaitu massa air dalam kalorimeter (gram), perubahan suhu air (0C), dan kalor jenis air. Rumusnya ditulis: q = kalor yang dibebaskan atau diserap
q = kalor yang dibebaskan atau diserap
 Jumlah kalor yang terserap ke dalam air dihitung dengan mengalikan 3 faktor yaitu massa air dalam kalorimeter (gram), perubahan suhu air (0C), dan kalor jenis air. Rumusnya ditulis:
Jumlah kalor yang terserap ke dalam air dihitung dengan mengalikan 3 faktor yaitu massa air dalam kalorimeter (gram), perubahan suhu air (0C), dan kalor jenis air. Rumusnya ditulis: q = kalor yang dibebaskan atau diserap
q = kalor yang dibebaskan atau diserap
m = massa air (gram)
c = kapasitas kalor air (J)
Dt = perubahan suhu (0C)

b. Penentuan DH Berdasarkan DHf0
Berdasarkan perubahan entalpi pembentukan standar zat-zat yang ada dalam reaksi, perubahan entalpi reaksi dapat dihitung dengan rumus:
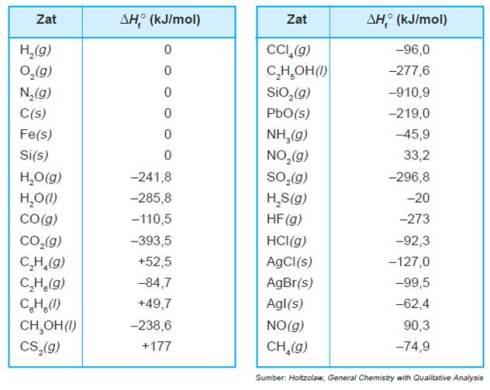
Perubahan entalpi pembentukan beberapa zat dapat dilihat pada Tabel di bawah.
Tabel: Perubahan entalpi pembentukan beberapa zat (t = 250C)
Perubahan entalpi reaksi kadang-kadang tidak dapat ditentukan secara langsung tetapi harus melalui tahap-tahap reaksi. Misalnya untuk menentukan perubahan entalpi pembentukan CO2 dapat dilakukan dengan berbagai cara.
 Pada cara 1, reaksi berlangsung satu tahap, sedangkan cara 2 dan cara 3 berlangsung dua tahap. Ternyata dengan beberapa cara, perubahan entalpinya sama yaitu –394 kJ.
Pada cara 1, reaksi berlangsung satu tahap, sedangkan cara 2 dan cara 3 berlangsung dua tahap. Ternyata dengan beberapa cara, perubahan entalpinya sama yaitu –394 kJ.Seorang ilmuwan, German Hess, telah melakukan beberapa penelitian perubahan entalpi ini dan hasilnya adalah bahwa perubahan entalpi reaksi dari suatu reaksi tidak bergantung pada jalannya reaksi, apakah reaksi tersebut berlangsung satu tahap atau beberapa tahap. Penemuan ini dikenal dengan Hukum Hess yang berbunyi:

Berdasarkan penelitian Hess ini, perubahan entalpi suatu reaksi yang tidak dapat ditentukan dengan kalorimeter dapat ditentukan dengan perhitungan. Berikut ini contoh perhitungan penentuan perubahan entalpi.
c. Penentuan DH Berdasarkan Energi Ikatan
Suatu reaksi kimia terjadi akibat pemutusan ikatan-ikatan kimia dan pembentukan ikatan-ikatan kimia yang baru. Pada waktu pembentukan ikatan kimia dari atom-atom akan terjadi pembebasan energi, sedangkan untuk memutuskan ikatan diperlukan energi. Jumlah energi yang diperlukan untuk memutuskan ikatan antaratom dalam 1 mol molekul berwujud gas disebut energy ikatan. Makin kuat ikatan makin besar energi yang diperlukan. Beberapa harga energi ikatan dapat dilihat pada Tabel berikut:
Tabel: Beberapa harga energi ikatan

Harga energi ikatan dapat dipakai untuk menentukan H suatu reaksi.
Dengan rumus tersebut dapat pula ditentukan energi ikatan rata-rata suatu molekul dan energi yang diperlukan untuk memutuskan salah satu ikatan atau energi ikatan disosiasi dari suatu molekul. Berikut ini contoh perhitungan DH dengan menggunakan harga energi ikatan.